近年来,中晚期癌症患者的治疗盲目地进行过多的手术、化疗、放疗,一味地追求消灭肿瘤,企图达到完全康复的目的。但殊不知,中晚期癌症患者由于机体状态本身就差,过度的治疗会严重损伤抵抗力,反而容易反复发作,加速死亡。
无癌家园专家指出,中晚期癌症的治疗不能一味地追求肿瘤的消退,而应该把重点放在控制肿瘤,延长患者的生存期,实现长期“带瘤生存”,争取与肿瘤细胞“和平共处”,使癌症也变成糖尿病、心脏病等普通慢性病一样,才是科学抗癌的正确理念。
近十年来,随着免疫药物及靶向药物的兴起,众多的靶向药物和免疫药物纷纷上市,除此之外,各国医学科研工作者也在积极地研究各种治疗癌症的黑科技,曾经被视为天方夜谭的难治性癌症,都渐渐地朝着慢性病的方向转变。
从国情出发,我国的医疗与发达国家差距较大,许多新药新疗法耗资巨大、价格昂贵,癌友们只能望洋兴叹。但是近两年来我们国家加快了新药的审批,以及新技术的研发。在2022年快要过半之际,有多款新药新技术强势登陆中国,而且都恰巧在国内有临床招募,尤其以细胞免疫疗法发展最为迅猛!那么,无癌家园小编今天就迫不及待地给大家介绍这些国际先进前沿新技术新疗法!
细胞免疫疗法
细胞免疫疗法利用的就是人体免疫系统的自我保护及查杀能力,来实现抗肿瘤的作用。通过把患者体内具有免疫功能的细胞提出体外培养、增殖,通过技术手段让它们拥有攻击肿瘤细胞的能力,然后再输入患者体内,实现自身抗癌。这种疗法针对免疫细胞,而不是癌细胞,也不像手术、放疗、化疗那样会对患者身体造成巨大危害,对于早期癌症患者可以直接治疗,特别是配合手术后对残留癌细胞的攻击效果最明显。
从近些年在科研和临床上的迅猛发展来看,细胞免疫疗法在精准性、有效性和安全性等方面更让人寄予厚望,有望迅速崛起成为抗癌疗法的第四大支柱。尤其是到了2022年,细胞免疫疗法继续延续2021年的强劲势头,发展更为迅猛,而且有多种疗法在国内均在进行临床招募,覆盖多样癌种的患者,让越来越多的中国癌症患者得到临床获益!
01、CAR-T细胞疗法
CAR-T疗法就是嵌合抗原受体T细胞免疫疗法,是一种治疗肿瘤的新型精准靶向疗法。通过基因工程技术将T细胞激活,并装上定位导航装置CAR(肿瘤嵌合抗原受体),将T细胞这个普通“战士”改造成“超级战士”,即CAR-T细胞,专门识别体内肿瘤细胞,并高效杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。
目前,随着2021年阿基仑赛注射液、瑞基奥仑赛注射液先后在中国获批上市,2022年西达基奥仑赛被美国FDA获批上市,CAR-T疗法已然进入井喷期。尤其是CAR-T技术在多种血液肿瘤,如白血病、淋巴瘤、多发性骨髓瘤中,表现出不俗的疗效,让许多濒临绝境、无药可治的血癌患者,一大半都获得了良好的疗效。
此外,CAR-T疗法在胃癌、肝癌、胰腺癌等领域都有着卓越的进步。国内外的学者更是针对CAR-T进行了多种改造,不断地发现新靶点,以用于治疗多种实体肿瘤。
01.爆!中国首款、全球第2款BCMA CAR-T疗法获FDA批准
2022年2月28日,由杨森公司(Janssen)和传奇生物合作开发的BCMA CAR-T产品西达基奥仑赛(商品名Carvykti),已获得美国FDA批准上市,用于治疗复发/难治性多发性骨髓瘤成人患者(MM)。
这是中国首款获得FDA批准的细胞治疗产品,也是全球第二款获批靶向BCMA的CAR-T细胞免疫疗法。

BCMA CAR-T疗法报道
cilta-cel是一种研究性B细胞成熟抗原(BCMA)导向的CAR-T疗法,用于治疗复发或难治性多发性骨髓瘤(RRMM)。
在2021年的ASH会议上报道的最新结果显示,中位22个月的长期随访,客观缓解率(ORR)达到了98%,83%的患者达到严格的完全缓解(sCR),强调随着时间的推移缓解加深(sCR从2020年ASH年会上报告的67%增加到83%)。在18个月时,有66%的患者存活且疾病无进展。两年无进展生存率和总生存率分别为61%和74%。在2021年ASCO年会上将要公布的最新研究结果显示,中位随访18个月,总生存(OS)率为81%,缓解率在全部预先指定的亚组和不同治疗线数患者中具有可比性。
如何寻求CAR-T细胞治疗>>
自从靶向BCMA的西达基奥仑赛被FDA批准上市外,复发或难治性多发骨髓瘤患者这个群体就受到大家的格外重视,对于这一血液系统的第二大常见恶性肿瘤,CAR-T疗法无疑给癌友们提供了新的治疗选择!
目前无癌家园也正有两款针对多发性骨髓瘤的CAR-T疗法以及一款靶向CD19/CD20/CD22的三靶点CAR-T临床试验,主要是针对B细胞急性淋巴细胞白血病患者的CAR-T临床试验正在临床招募中,想要参加的患者可提交病理报告、治疗经历、出院小结等资料至无癌家园医学部初步评估病情。
02.剑指胃癌,国产CAR-T疗法CT041进入确认性Ⅱ期临床试验
作为国际上首个针对Claudin18.2的CAR-T细胞,CT041早在2019年ASCO年会上就崭露头角,当时总客观缓解率为33.3%就已经惊艳世界,如今更加显著的疗效无疑是锦上添花!此次的临床数据展现出对消化系统肿瘤的良好治疗前景!
2022年5月9日,科济药业CAR-T细胞产品CT041治疗消化系统肿瘤的研究结果发表在国际顶级期刊《Nature Medicine》杂志上,这也算是首个发表于顶级学术期刊的迄今为止最大样本量的CAR-T细胞治疗实体瘤的临床研究!
研究数据格外亮眼
1)所有患者的客观缓解率达48.6%,疾病控制率达73%;所有胃癌患者总客观缓解率为57.1%,疾病控制率达75.0%。
2)既往接受至少2线治疗失败的胃癌患者:客观缓解率为61.1%,疾病控制率为83.3%。
3)而且总体耐受性良好!
截止到2022年3月3日,CT041成为全球首个且唯一进入到确证性Ⅱ期临床试验的用于治疗实体瘤的CAR-T细胞候选产品。这是CAR-T攻克实体瘤领域是里程碑般的存在,可喜可贺!
除此之外,还有多款靶向CLDN18.2的CAR-T细胞疗法。例如,由传奇生物研发的LB-1904,用于治疗胃癌或者胰腺癌,目前已经进入临床I期试验。此外,我国自主研发的首个针对Claudin18.2的单抗AB011,用于治疗晚期胃腺癌及实体瘤患者,目前也正在进行临床试验招募中。
目前急招B细胞淋巴瘤、T细胞淋巴瘤、T细胞白血病(T-ALL)、急性白血病、非霍奇金淋巴瘤、肝癌、胃癌、前列腺癌、甲状腺癌等癌种!
想要评估病情是否能够接受CAR-T疗法可将病理报告、治疗经历及出院小结等提交至无癌家园医学部进行初步评估!
03.靶向结直肠癌!斯丹赛实体瘤CAR-T疗法闪耀国际
2022年5月17日,上海斯丹赛生物公司宣布,其将出席2022年5月15日-5月19日在华盛顿举行的美国基因与细胞治疗学会(ASGCT)第25届年会并做口头报告。
会上,斯丹赛将做基于自主研发的CoupledCAR®平台技术开发的首发候选产品GCC19CART的报告,该产品被开发用于治疗复发/难治性结直肠癌(R/R mCRC)患者。
2022年4月19日,上海斯丹赛生物宣布,其开发的实体瘤CAR-T产品GCC19CART被美国食品和药物管理局(FDA)授予快速通道资格。
GCC19CART是一款自体CAR-T治疗产品,是用于治疗复发难治转移型结直肠癌(R/R mCRC)的实体肿瘤领先疗法。不得不说,这项殊荣让CAR-T疗法在攻克实体瘤的道路上又迈出了坚实的一步,可喜可贺!
据无癌家园小编获悉,在本次ASGCT会议上,斯丹赛将会重点介绍来自中国5家临床中心2个剂量爬坡试验组21例患者的数据,验证了GCC19CART产品的安全性和初步疗效。其中13患者以1级剂量(1x106 cells/kg)入组,8名患者以2级剂量(2x106 cells/kg)入组。根据实体肿瘤疗效评价标准(RECIST1.1),1级剂量组客观缓解率(ORR)为15.4%(2/13),2级剂量组客观缓解率为50%(4/8)。
无癌家园临床招募
目前,斯丹赛的CAR-T细胞疗法进行临床招募中,主要是关于晚期实体瘤的临床研究。
其中涵盖14大癌种,包括结直肠癌、肺癌、乳腺癌、肝癌、膀胱癌、食管癌、肾癌、卵巢癌、子宫癌、黑色素瘤、胃癌、胰腺癌、滑膜肉瘤、头颈癌。
具体的入排标准可详情咨询无癌家园医学部,会进行详细的医学评估。
02、TCR-T治疗
CAR-T细胞和TCR-T细胞都属于经基因工程技术改造的T细胞。相较于CAR-T疗法,TCR-T疗法在实体瘤治疗领域具备独特优势。
TCR-T细胞疗法可识别细胞膜表面或细胞内来源的肿瘤特异性抗原,已从最开始的基础免疫研究走进临床应用,在实体瘤中显示出初步疗效,成为目前最有可能在实体瘤领域中取得突破的T细胞免疫疗法!
何谓TCR-T细胞疗法
TCR-T技术主要机制是向普通T细胞中引入新的基因,使得改造过的T细胞能够表达有效识别肿瘤细胞的TCR(T cell receptor,T细胞抗原受体),从而引导T细胞杀死肿瘤细胞。
肝癌TCR-T产品获批临床情况
2022年5月9日,星汉德生物的SCG101自体T细胞注射液获得新加坡药监局(HSA)的临床试验批准。而在3月10日,中国国家药品监督管理局药品审评中心(CDE)公示显示,SCG101自体T细胞注射液成功获得临床试验默示许可,用于治疗乙型肝炎病毒(HBV)相关的肝细胞癌(HCC)。
SCG101临床试验许可
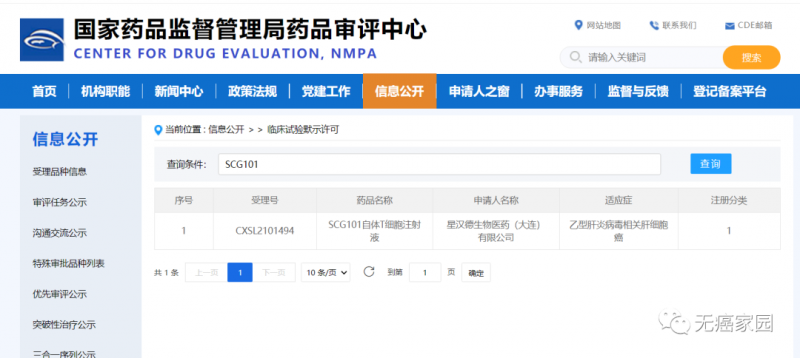
▲ 图片来源:CDE官网
2022年4月20日,香雪生命科学的创新产品TAEST1901注射液,已获得中国国家药监局(NMPA)临床试验许可,拟用于治疗组织基因型为HLA-A*02:01、肿瘤抗原AFP表达为阳性的晚期肝癌或其它晚期肿瘤。
TAEST1901注射液临床试验获批

▲ 图片来源:CDE官网
无癌家园TCR-T疗法招募
那么到底有没有机会尝试TCR-T疗法呢?小编这就带来了一个好消息,目前正有一项研发的TCR-T疗法在招募肝癌患者开展临床试验,想要参加的患者可以咨询无癌家园医学部了解详细入排标准。
03、CAR-NK治疗
近两年来,除了CAR-T疗法备受万众瞩目外,另外一种新的癌症细胞疗法——自然杀伤(NK)细胞疗法也逐渐受到关注。研究人员说,NK细胞作为一种细胞抗癌疗法更具潜力,它可能会更安全、更便宜、更快速。
CAR-T细胞疗法取得的成功激发了人们对用CAR基因修饰NK细胞来增强其杀肿瘤能力的热情。
CAR-NK就是利用基因工程给NK细胞加入一个能识别肿瘤细胞,并且同时激活NK细胞杀死肿瘤细胞的嵌合抗体。2020年,CAR-NK免疫细胞治疗曾被权威学术期刊《自然-医学》纳入度生物医学领域的十代瞩目进展之一。
想寻求CAR-NK细胞疗法及其他国内外治疗新技术帮助的患者可以先将病历提交至无癌家园医学部进行初步评估。
大放异彩,CAR-NK疗法在实体瘤中的成就不容小觑
1、创新CAR-NK疗法FT536获FDA批准用于临床试验
2022年1月10日,Fate Therapeutics公司宣布,美国FDA已批准FT536的新药临床研究(IND)申请。FT536是一款经过多重工程修饰、诱导多能干细胞(iPSC)衍生的“即用型”嵌合抗原受体(CAR)自然杀伤(NK)细胞疗法。

CAR-NK疗法FT536获批临床试验
FT536表达一种特异性靶向I类主要组织相容性复合体(MHC)相关蛋白A和B(MICA/MICB)α3结构域的新型CAR。
MICA和MICB属于应激蛋白,在许多实体瘤上高水平表达。癌细胞经常通过MICA/B的α1和α2结构域的蛋白水解脱落来逃逸免疫细胞识别。此前有研究发现,靶向MICA/B的α3结构域的抗体能够特异性地阻止MICA/B脱落,恢复NK细胞介导的免疫力。
此次FT536获批临床应用,表明MICA和MICB正在成为广泛的实体瘤中令人兴奋的癌症免疫疗法靶标,而FT536也代表了一种靶向这些应激诱导配体的新型治疗策略。关于此款疗法的多中心I期临床试验开展的肿瘤类型包括:晚期非小细胞肺癌、结直肠癌、头颈癌、胃癌、乳腺癌、卵巢癌和胰腺癌。
2、"现货型"CAR-NK疗法向"癌王"胰腺癌发起进攻
2022年1月6日,在国际胃肠病领域权威杂志《Gastroenterology》刊登了希望之城国家医学中心和细胞疗法创新公司CytoImmune Therapeutics合作开发的重磅研究,研究结果显示,以前列腺干细胞抗原(PSCA)为靶点的“现成”的CAR-NK疗法能够显著抑制胰腺癌。这款被称为CYTO NK-203的治疗方法,是一种现成的同种异体 CAR-NK 细胞疗法,源自脐带血,并具有提高 NK 细胞安全性和杀伤功效的一种潜在的疗法。
CYTO NK-203在人类转移性胰腺癌小鼠模型中效果显著,在小鼠体内持续存活超过90天,显著延长其寿命,且未显示出治疗相关毒性,这项临床前研究支持该疗法在今年进入人体临床试验。
研究团队认为这种CAR-NK疗法对胰腺癌治疗充满希望,原因有两个:首先,该疗法基于精准医学方法,靶向胰腺癌患者的特殊靶点——PSCA;这是一种免疫疗法,使用工程化的人类自然杀伤细胞,被改造为专门攻击癌细胞。
此外,由于前列腺干细胞抗原(PSCA)在胃癌、前列腺癌中也同样高表达,因为这款CAR-NK细胞疗法同样对胃癌和前列腺癌的治疗充满希望。
除了上述提到的国内临床研究外,CAR-NK细胞还对卵巢癌、结直肠癌、非小细胞肺癌、胶质母细胞瘤和神经母细胞瘤、肝癌等的疗效颇佳,特异性识别和高效杀伤乳腺癌肿瘤细胞,对多发性骨髓瘤疗效显著。
广谱抗癌药
近期,癌症靶向治疗进展非常迅速,无论国内外,均有不少高效的靶向药纷纷获批上市或投入使用。就在2022年刚刚结束不久的美国肿瘤研究协会(AACR)年会上,众多备受癌友们关注的靶向药如雨后春笋般不断涌现,让无数癌友重新点燃生的希望。那么,今天无癌家园的小编就盘点下热门靶向药的最新临床研究。
"钻石"靶点——NTRK
NTRK之所以被称为“钻石”基因,首先是因为它非常罕见,在中国常见的肺癌、乳腺癌、结直肠癌中,只有1%~5%的患者存在这种突变,而一些罕见的癌症,比如婴儿纤维肉瘤和分泌型乳腺癌,存在NTRK融合的频率却高达90%~100%。其次,针对NTRK融合突变上市的药物及在研的药物临床效果显著,接受治疗的患者通常都能快速起效,很多晚期患者在使用NTRK抑制剂后得到了重生,像钻石一样罕见又珍贵。
重磅!横扫21类癌种的"传奇"抗癌药拉罗替尼在中国上市
作为全球首个不分肿瘤来源用于初始治疗的靶向药,拉罗替尼于2018年11月26日被FDA批准上市,用于成人和小儿具有神经营养受体酪氨酸激酶(NTRK)基因融合的实体瘤治疗。
就在2022年4月13日,我国的癌友们苦等了3年多的“传奇”抗癌药拉罗替尼(larotrectinib,硫酸拉罗替尼,商品名:Vitrakvi)终于获得中国国家药监局(NMPA)的批准上市,用于治疗携带NTRK融合基因的实体瘤成人和儿童患者。这表明,中国癌友们迎来了全球首款专为NTRK基因融合癌症患者设计的口服TRK抑制剂。
截止到目前已发现NTRK融合存在于超过25类癌症中,包括乳腺癌、结直肠癌、肺癌、甲状腺癌等,成人和儿童患者都可以使用。
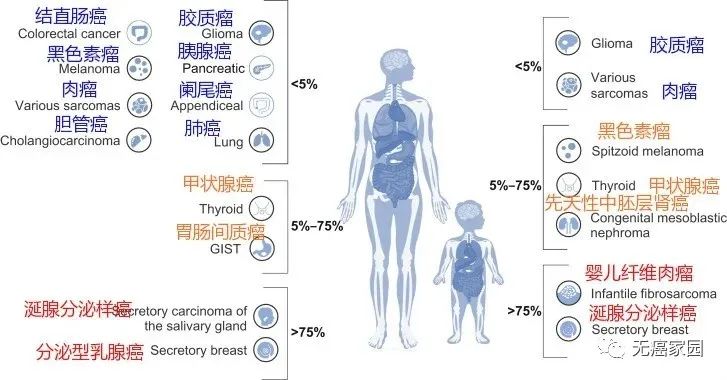
各癌种NTRK突变的概率
除了拉罗替尼外,目前全球对于NTRK药物的研发正在如火如荼地进行中,给更多患者带来新希望!无癌家园特地为各位癌友们整理了目前正在招募的NTRK抑制剂的信息,希望给各位急于寻医问药的患者更多的治疗选择!
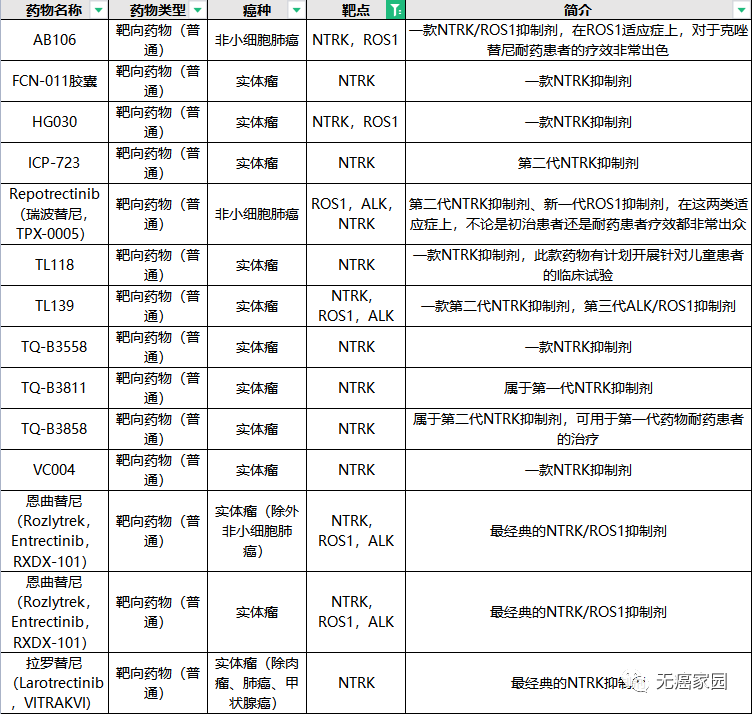
NTRK临床试验
"钉子户"靶点——KRAS
KRAS是实体瘤中最常见的癌基因之一,大约30%的肿瘤都存在KRAS突变,包括90%的胰腺癌,30%~40%的结肠癌和15%~20%的肺癌。然而,KRAS靶向药却寥寥无几,KRAS一度成为无药可用的最难突变。
疾病控制率85.7%,国产靶向药D-1553首次亮相AACR
D-1553是由益方生物自主开发的一款新型,高效且口服的KRAS G12C抑制剂。近日,在2022年美国肿瘤研究协会(AACR)年会上,益方生物首次公布了其口服KRAS G12C抑制剂D-1553在癌症患者中的临床I期数据,这使得D-1553成为了首个公布临床数据的国产KRAS抑制剂。
在一项针对携带KRAS G12C突变的晚期或转移性实体瘤患者的国际多中心一期研究中 ,D-1553在22例患者中耐受性良好,没有任何剂量限制性毒性。在21例可评估的患者中,观察到19.0%确认的肿瘤客观缓解率,达到了85.7%的疾病控制率。在剂量水平低至每天300mg时已观察到肿瘤缓解。
在另一项由上海胸科医院陆舜教授为主要研究者,针对携带KRAS G12C突变的非小细胞肺癌(NSCLC)患者的研究分析中包括了59例患者,其中52例为可评估患者,肿瘤客观缓解率达到40.4%,疾病控制率高达90.4%。这些患者均为晚期或转移性癌症患者,大多数已经接受了二线或二线以上的系统性抗癌药物治疗。
数据显示,在PR2D(600mg/BID,BID为一日两次)剂量下,D-1553在32例患者中评估的客观缓解率达到40.6%,疾病控制率为84.4%。安全性方面,D-1553耐受性良好,未达到剂量限制性毒性。
据悉,D-1553已于2020年10月获得美国FDA批准在美国、澳大利亚、中国台湾、韩国等国家和地区启动了国际多中心I/II期临床试验,目前进展顺利。并于2021年1月获得中国国家药品监督管理局药品审评中心批准开展 I/II 期临床试验。
好消息是,针对KRAS G12c突变的各类实体瘤患者,D-1553已经正式开始招募患者了!
如果您是以下类型的癌种,请速速联系我们
目前急招肠癌、胰腺癌、胆管癌、子宫内膜癌及卵巢癌的KRAS G12C患者,想要参加者可以咨询无癌家园医学部了解该试验。
除了Lumakras、D-1553外,在医学研究者们不断地努力之下,KRAS这座堡垒终于破防,多款新药不断涌现,并已有多个在研药物在临床研究阶段取得了早期成功:包括:Adagrasib(MRTX849)、JNJ-74699157 (ARS-3248)、JAB-3312、LY3499446以及泛KRAS抑制剂BI 1701963等。
钻石突变——ALK
对于确定为ALK阳性的患者是幸运的,因为针对ALK的靶向药有效率超高,副作用不大,一不注意肿瘤就给“吃没了”。肺癌中的ALK基因融合突变,大约存在于3%~7%的非小细胞肺癌,患者人数并不多。但具有ALK突变的晚期非小细胞肺癌患者,使用ALK抑制剂阿来替尼或克唑替尼,5年生存率都超过了60%。因此,ALK突变也因其罕见但有效的特点被称为“钻石突变”。
中国人群肺腺癌ALK融合阳性率为5.1%,而我国EGFR和KRAS均为野生型的腺癌患者中ALK融合基因的阳性率高达30%~42%。对于非小细胞肺癌来说,年轻、女性、亚裔不吸烟的患者较易出现ALK基因突变。
终于等到了!第三代ALK抑制剂劳拉替尼在中国获批上市
2022年4月28日,辉瑞的ALK抑制剂洛拉替尼获国家药品监督管理局(NMPA)批准上市,用于治疗ALK阳性晚期非小细胞肺癌。这也是国内首款获批的第三代ALK 抑制剂。
根据劳拉替尼治疗中国患者的临床试验数据,仅接受过克唑替尼治疗的患者,接受劳拉替尼治疗,整体缓解率为70.1%,其中完全缓解率11.9%;基线存在脑转移的患者,颅内病灶的整体缓解率为80.6%,完全缓解率高达52.8%。
而接受过其它ALK抑制剂治疗的患者,接受劳拉替尼治疗的整体缓解率为47.6%,其中完全缓解率为4.8%;基线存在脑转移的患者,颅内病灶整体缓解率为47.6%,其中完全缓解率为28.6%。
目前无癌家园有多款针对ALK突变的靶向药(仅展示部分)正在招募中!
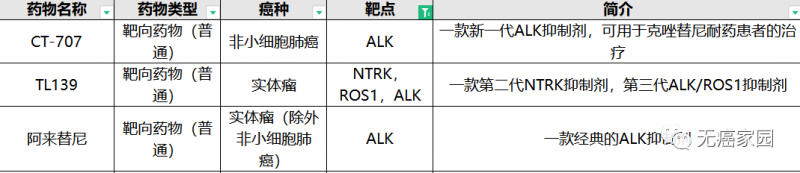
ALK临床试验
想要评估病情是否符合上述招募条件可将病理报告、治疗经历及出院小结等提交至无癌家园医学部进行初步评估!
热门靶点——FGFR
FGFR基因变异通常在肺癌、肝癌、肝内胆管癌、乳腺癌、胃癌、子宫癌及尿路上皮癌等实体瘤中广泛存在,并且不同癌种的FGFR突变类型及频率也存在差异。
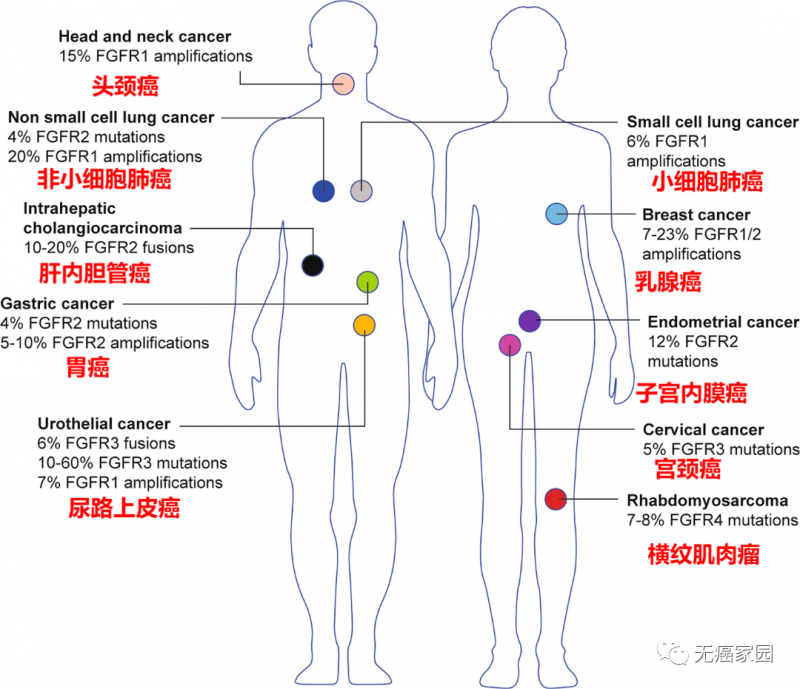
具有FGFR改变的癌症类型
疾病控制率100%!国内胆管癌史上首款靶向药Pemigatinib闪亮登场
2022年4月6日,信达生物宣布其引进的佩米替尼片(Pemigatinib,商品名:达伯坦)在中国获批上市,用于既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者的治疗。

Pemigatinib获批临床试验

Pemigatinib临床试验获批情况
截图源自NMPA官网
这则振奋人心的消息意味着国内首款获批上市的FGFR抑制剂终于来了,它的上市填补了国内胆管癌靶向治疗的空白,也意味着唯化疗时代的终结。
与此同时,FGFR靶向药也逐渐进入到大众的视野中,对于FGFR靶点,各位癌友们可能比较陌生。但是作为目前“不限癌种”疗法的聚焦的热门靶点之一,FGFR(成纤维细胞生长因子受体)上市的适应症主要集中在胆管癌和尿路上皮癌上,除此之外,该靶点覆盖了超过16大癌种,主要包括肺鳞癌、肝癌、胃癌、乳腺癌等多种实体瘤。
为了方便癌友们更加直观了解关于FGFR抑制剂的临床试验,小编特地整理无癌家园目前正在招募中的临床试验项目,其中涵盖了胆管癌、肝癌及胃癌等实体瘤癌种。
想要评估病情是否能够接受新药临床试验,可将病理报告、治疗经历及出院小结等提交至无癌家园医学部进行初步评估!

FGFR抑制剂临床试验
小编有话说
近年来由于医疗水平的发展,新型的癌症治疗手段及抗癌新药相继出现,其中细胞免疫治疗及靶向药的研发如火如荼地开展,给肿瘤患者带来了新的希望。
根据最新统计资料显示,相对于只接受手术、放疗、化疗的晚期肺癌、胃癌、肝癌等患者来说,辅助细胞免疫疗法或采用靶向治疗能够让患者延长生存期,显著提高资料效果。
实际上,肿瘤治疗其实是一项复杂的“工程”,单纯凭借某一种治疗手段很难取得良好的效果,肿瘤治疗需要综合各种治疗手段相互配合才有可能在抗癌的斗争中取得最后的胜利。
文章来源:http://www.globecancer.com/azzx/show.php?itemid=15257
 关注我了解更多
关注我了解更多